Cardiopatía congénita: anomalía de Ebstein
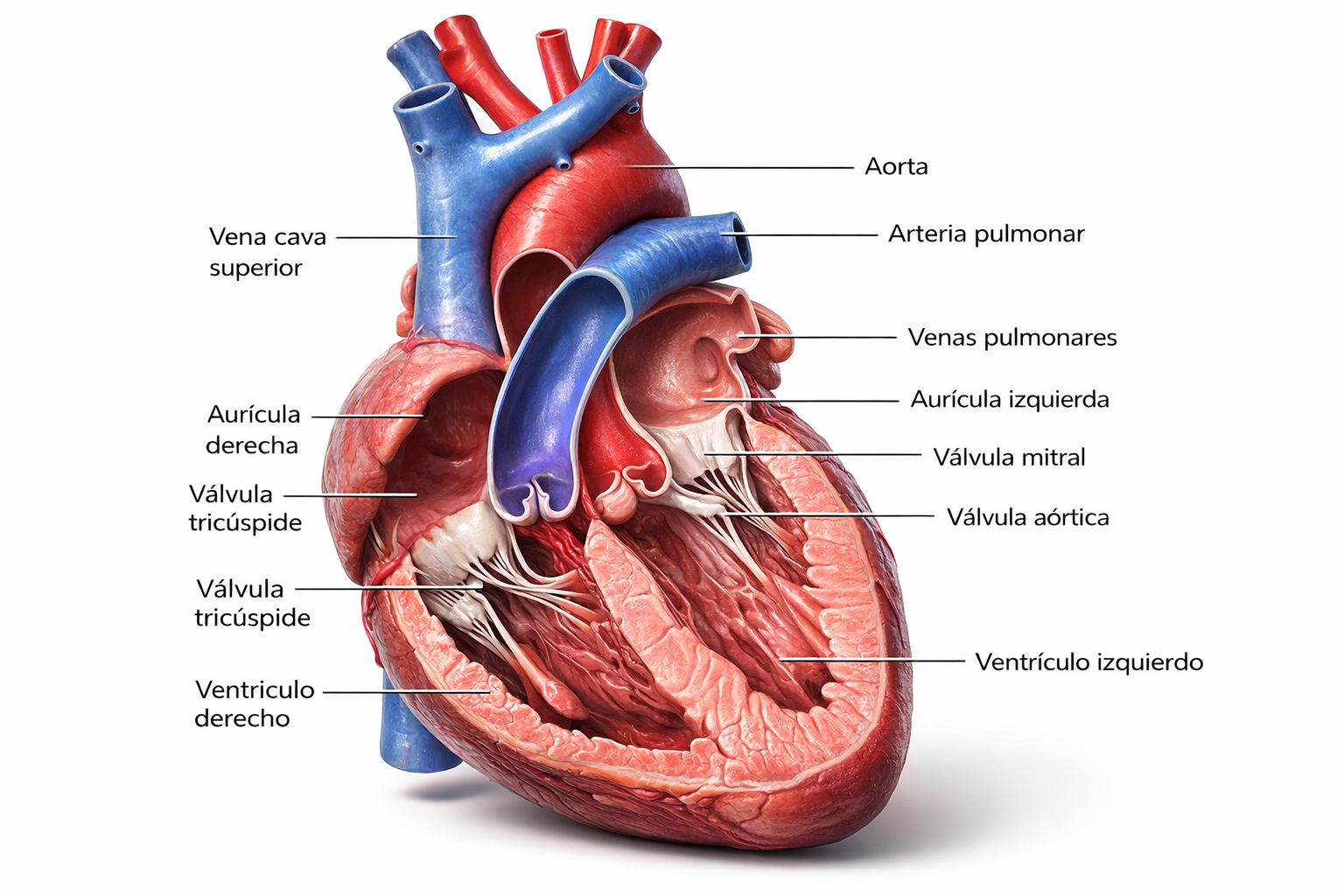
Descripción de la patología
La anomalía de Ebstein es una cardiopatía congénita rara caracterizada por el desplazamiento apical de la válvula tricúspide hacia el ventrículo derecho, con adherencia de los velos septal e inferior a la pared ventricular, lo que produce “atrialización” de parte del ventrículo derecho y una cavidad funcional reducida. Esta malformación se acompaña de grados variables de insuficiencia tricuspídea, dilatación marcada de la aurícula derecha y, con frecuencia, comunicaciones interauriculares o foramen oval permeable que permiten cortocircuitos derecha–izquierda y cianosis. La presentación clínica es muy heterogénea: algunos pacientes son asintomáticos o presentan soplo incidental, mientras que otros debutan en el periodo neonatal con insuficiencia cardiaca, hipoxia grave y arritmias supraventriculares, incluyendo síndrome de Wolff–Parkinson–White. La gravedad depende del grado de desplazamiento valvular, del tamaño del ventrículo derecho funcional y del nivel de regurgitación tricuspídea, por lo que la estratificación anatómica y funcional mediante ecocardiografía, resonancia cardiaca y estudios electrofisiológicos resulta esencial para orientar el pronóstico y el manejo terapéutico.
Historia de la patología
La anomalía de Ebstein fue descrita por primera vez en 1866 por el médico alemán Wilhelm Ebstein, quien publicó el hallazgo de una válvula tricúspide desplazada y deformada en un joven de 19 años con cianosis y cardiomegalia, sentando las bases para el reconocimiento de esta entidad como una malformación congénita específica. Durante gran parte del siglo XX se consideró una lesión excepcional, diagnosticada casi exclusivamente en la autopsia, hasta que la radiografía de tórax, el electrocardiograma y, más tarde, la ecocardiografía permitieron identificarla en vida y correlacionar los hallazgos clínicos con la anatomía valvular. A partir de los años 70 y 80, el desarrollo de la cirugía cardiaca congénita introdujo técnicas de reparación y sustitución de la válvula tricúspide, y se describieron clasificaciones morfológicas (como la de Carpentier) que ayudaron a estandarizar la descripción anatómica y guiar las decisiones quirúrgicas. En las últimas décadas, los avances en imagen fetal han permitido el diagnóstico prenatal, la planificación del parto en centros de referencia y la mejora en la supervivencia neonatal, mientras que nuevas técnicas quirúrgicas como la plastia tipo cone y las estrategias biventriculares o de ventrículo y medio han optimizado los resultados a largo plazo.
Descripción anatómica general
Anatómicamente, la anomalía de Ebstein se caracteriza por el desplazamiento apical del plano valvular tricuspídeo funcional, la adherencia de las valvas septal e inferior a la pared del ventrículo derecho y una dilatación marcada de la aurícula derecha, con atrialización de la porción proximal del ventrículo. La valva anterior suele ser grande, redundante y en “vela”, con movilidad que varía desde casi normal hasta severamente limitada; su grado de tethering y la presencia de fenestraciones condicionan la severidad de la insuficiencia tricuspídea. La combinación de atrialización, anillo tricuspídeo dilatado y aparato subvalvular deformado altera de manera significativa la geometría del ventrículo derecho y del tracto de salida, modificando la relación entre el plano de apertura y el infundíbulo. Para ordenar este espectro anatómico se emplean la clasificación de Carpentier y otras clasificaciones ecocardiográficas y quirúrgicas, que relacionan la cantidad de ventrículo derecho funcional, el grado de desplazamiento valvular y la morfología de la valva anterior con el impacto hemodinámico y las posibilidades de reparación biventricular, de ventrículo y medio o estrategias de ventrículo único.
Clasificación de Carpentier tipo A
En el tipo A de Carpentier, el volumen del ventrículo derecho funcional es adecuado y la porción atrializada es relativamente pequeña, de modo que la geometría global del ventrículo se aproxima a la normal. Las valvas septal e inferior presentan un desplazamiento apical discreto y cierta displasia (engrosamiento, irregularidad de bordes, inserciones anómalas), pero conservan una longitud y superficie suficientes para coaptar con la valva anterior. Esta última suele ser grande, delgada, bien delaminada y con redundancia moderada, a menudo con aspecto “en vela”, aunque sin fenestraciones extensas ni tethering severo, lo que limita la regurgitación tricuspídea. El anillo tricuspídeo puede encontrarse mínimamente dilatado y el miocardio de la porción atrializada solo muestra adelgazamiento leve, sin áreas aneurismáticas ni fibrosis extensa, mientras que el ventrículo derecho funcional mantiene grosor y trabeculación relativamente conservados. La aurícula derecha está dilatada de forma discreta o moderada, en ocasiones con focos de fibrosis endocárdica, pero sin la enorme distensión observada en formas más avanzadas. La repercusión principal suele ser el riesgo de arritmias supraventriculares por dilatación auricular o presencia de vías accesorias, por lo que el seguimiento se centra en la vigilancia electrocardiográfica y en la valoración periódica de la regurgitación tricuspídea, reservando la cirugía para casos con progresión de síntomas o dilatación ventricular.
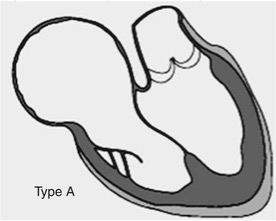
Clasificación de Carpentier tipo B
En el tipo B, la atrialización del ventrículo derecho es mayor debido a un defecto de delaminación más extenso de las valvas septal y posterior, pero el ventrículo derecho funcional conserva aún un tamaño moderado que permite un gasto cardiaco aceptable. Macroscópicamente, se observa una aurícula derecha muy dilatada que se continúa hacia abajo con una “cavidad” atrializada formada por el segmento proximal del ventrículo derecho, de pared adelgazada y trabeculación irregular, separada de la cavidad ventricular funcional por la inserción apicalmente desplazada de las valvas septal e inferior. Estas valvas muestran delaminación incompleta: permanecen parcialmente fusionadas al miocardio subyacente, con cuerdas tendinosas cortas o ausentes y zonas de engrosamiento y displasia que contribuyen a una coaptación deficiente. La valva anterior, en cambio, suele ser grande, redundante y en forma de vela; se extiende ampliamente hacia la cavidad del ventrículo derecho funcional, con buena delaminación pero a menudo con cierto tethering hacia el ápex y fenestraciones focales, configurando un aparato valvular excéntrico que genera jets regurgitantes amplios. El anillo tricuspídeo verdadero está dilatado y desplazado hacia el ventrículo, mientras que el anillo anatómico se sitúa a nivel del surco auriculoventricular, de modo que entre ambos se interpone la porción atrializada, cuya pared puede mostrar fibrosis subendocárdica, áreas de adelgazamiento y, en casos de larga evolución, focos aneurismáticos. El ventrículo derecho funcional, distal al anillo verdadero, presenta volumen reducido y geometría distorsionada, con remodelado de la pared libre y del tracto de salida; sin embargo, mantiene un grosor miocárdico relativamente conservado en comparación con los tipos más severos, lo que permite cierto margen de recuperación funcional tras la corrección quirúrgica. Microscópicamente, pueden encontrarse cambios de hipertrofia miocitaria y fibrosis intersticial tanto en la aurícula derecha como en la porción atrializada, reflejo de la sobrecarga crónica de volumen y de la dilatación mantenida, además de alteraciones en el sistema de conducción auricular que favorecen la aparición de vías accesorias y focos arrítmicos. En conjunto, la anatomía del tipo B se traduce en una insuficiencia tricuspídea moderada o severa, sobrecarga de volumen de la aurícula derecha y del ventrículo atrializado, pero con un ventrículo derecho funcional que aún puede participar de forma significativa en la circulación pulmonar, lo que hace de este subtipo un candidato frecuente para reparaciones biventriculares o de ventrículo y medio con resultados hemodinámicos favorables cuando se corrige adecuadamente la geometría valvular y la dilatación del anillo. La reserva funcional del ventrículo derecho hace que la reparación biventricular o la estrategia de ventrículo y medio sean frecuentemente factibles, y la decisión quirúrgica se apoya en la cuantificación ecocardiográfica del tamaño del ventrículo funcional, del grado de regurgitación y de la presencia de arritmias o deterioro de la capacidad funcional.
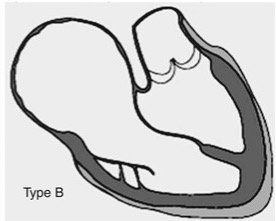
Clasificación de Carpentier tipo C
La anomalía de Ebstein tipo C según Carpentier corresponde a una forma avanzada del espectro anatomopatológico, en la que el defecto de delaminación de las valvas tricuspídeas es marcado y condiciona una atrialización extensa del ventrículo derecho con cavidad funcional pequeña y muy distorsionada. Macroscópicamente se observa una aurícula derecha masivamente dilatada que continúa hacia abajo con un ventrículo derecho atrializado amplio, de pared muy adelgazada, trabeculación pobre y aspecto casi aneurismático, separado del ventrículo derecho funcional por la inserción severamente desplazada de las valvas septal e inferior. Estas valvas permanecen ampliamente adheridas al endocardio del ventrículo atrializado, con cuerdas tendinosas rudimentarias o ausentes y engrosamiento displásico, por lo que casi no participan en la coaptación valvular. La valva anterior sigue siendo grande y redundante, pero a diferencia del tipo B su movilidad está claramente restringida por múltiples cuerdas y bandas anómalas que la tetherizan hacia la pared libre y el ápex, de manera que forma una especie de cortina intracavitaria que puede estrechar el paso entre la porción atrializada y el ventrículo funcional e incluso comprometer el tracto de salida del ventrículo derecho. El anillo tricuspídeo verdadero se encuentra fuertemente desplazado hacia el ápex y muy dilatado, mientras que el miocardio del ventrículo derecho funcional muestra hipertrofia y remodelado esférico, con volúmenes reducidos y contractilidad global disminuida. A nivel histológico, la pared del ventrículo atrializado presenta adelgazamiento extremo con fibrosis subendocárdica parcheada y posible infiltración grasa, reflejo de la sobrecarga crónica y la baja tensión sistólica, mientras que en la aurícula derecha se identifican áreas extensas de fibrosis y desorganización de fibras, que favorecen macroreentradas auriculares y vías accesorias. El resultado funcional de este sustrato anatomopatológico es una insuficiencia tricuspídea masiva, con regurgitación sistólica amplia hacia una aurícula derecha y un ventrículo atrializado gigantes, y un ventrículo derecho funcional demasiado pequeño y displásico para sostener un flujo pulmonar eficaz sin apoyo quirúrgico, lo que explica la elevada carga sintomática y la necesidad frecuente de reparaciones complejas, estrategias de ventrículo y medio o incluso circulación de ventrículo único en este subtipo. Hemodinámicamente, predomina la insuficiencia cardiaca derecha con aumento notable de la presión venosa sistémica, congestión hepática y edema periférico, además de hipoperfusión pulmonar relativa y cianosis cuando existe cortocircuito derecha–izquierda a nivel auricular. En este contexto, el ventrículo derecho tiene capacidad limitada para manejar el volumen regurgitante, por lo que la corrección quirúrgica suele requerir técnicas complejas como la plastia tipo cone asociada a reducción de la porción atrializada y, con frecuencia, la adición de una derivación cavopulmonar superior (reparación de ventrículo y medio) para descargar el ventrículo derecho y mejorar la hemodinamia.
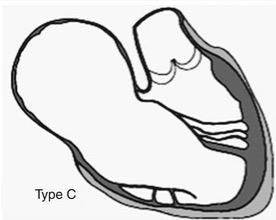
Clasificación de Carpentier tipo D
La anomalía de Ebstein tipo D según Carpentier representa el extremo más severo del espectro anatomopatológico y se caracteriza por una casi completa atrialización del ventrículo derecho, de modo que solo persiste como ventrículo funcional un pequeño segmento infundibular inmediatamente por debajo de la válvula pulmonar. Macroscópicamente, la aurícula derecha y la porción atrializada conforman una cavidad gigantesca, de pared muy adelgazada y trabeculación pobre, que ocupa gran parte del hemitórax derecho; el anillo tricuspídeo verdadero está profundamente desplazado hacia el ápex y enormemente dilatado, situándose muy cerca del tracto de salida del ventrículo derecho. Las tres valvas tricuspídeas muestran prácticamente no delaminación: septal, inferior y gran parte de la anterior permanecen fusionadas al endocardio del ventrículo atrializado, con cuerdas tendinosas rudimentarias o ausentes y severa displasia del tejido valvular, lo que impide una coaptación efectiva y genera insuficiencia tricuspídea masiva. La porción libre de la valva anterior puede adherirse en larga extensión a la pared lateral del ventrículo derecho, reduciendo aún más la cavidad funcional y contribuyendo a la obstrucción anatómica del tracto de salida; en muchos casos la única cámara contráctil reconocible es un pequeño infundíbulo subpulmonar hipoplásico, incapaz de generar un flujo pulmonar adecuado, condición conocida como “atresia pulmonar funcional”. Histológicamente, la pared del ventrículo atrializado presenta adelgazamiento extremo, fibrosis subendocárdica difusa e incluso áreas aneurismáticas predispuestas a ruptura, mientras que el miocardio del pequeño ventrículo funcional muestra signos de miopatía e hipertrofia adaptativa severa. La aurícula derecha presenta fibrosis extensa y desorganización de las fibras musculares, configurando un sustrato para macroreentradas auriculares y múltiples vías accesorias. Este escenario anatomopatológico explica la clínica dramática: regurgitación tricuspídea torrencial hacia una cámara derecha gigantesca, flujo anterógrado pulmonar mínimo, cortocircuito derecha–izquierda masivo a través de defectos interauriculares, cianosis profunda y fallo cardiaco neonatal, situación que con frecuencia obliga a estrategias paliativas de ventrículo único o incluso a considerar trasplante cardiaco en los casos más extremos.
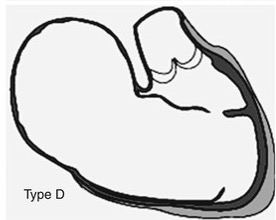
Las implicaciones hemodinámicas del tipo D son extremadamente graves y explican la alta mortalidad neonatal.
Insuficiencia tricuspídea masiva y cavidad derecha gigante: la casi ausencia de coaptación valvular produce regurgitación tricuspídea torrencial, de modo que gran parte del volumen sistólico del ventrículo derecho vuelve a la aurícula derecha y al ventrículo atrializado. Esto genera una cámara derecha enorme con presiones venosas sistémicas muy elevadas, congestión hepática severa, ascitis y fallo cardiaco derecho precoz.
Flujo pulmonar crítico y cortocircuito derecha–izquierda: el ventrículo derecho funcional se reduce a un pequeño infundíbulo hipoplásico, incapaz de impulsar un flujo adecuado hacia la arteria pulmonar, por lo que el flujo pulmonar es muy bajo o depende casi por completo del conducto arterioso (“atresia pulmonar funcional”). Como la presión auricular derecha supera a la izquierda, el cortocircuito derecha–izquierda a través de un foramen oval permeable o un defecto septal auricular es masivo, provocando cianosis profunda, hipoxemia refractaria y acidosis.
Gasto cardiaco sistémico reducido y arritmias: el compromiso del retorno pulmonar y del llenado del ventrículo izquierdo limita de forma crítica el gasto cardiaco sistémico, favoreciendo hipotensión, mala perfusión tisular y shock. La enorme aurícula derecha fibrosada es foco de taquiarritmias y vías accesorias, que agravan aún más la inestabilidad hemodinámica y pueden desencadenar episodios de colapso cardiovascular súbito.
Otras clasificaciones ecocardiográficas y quirúrgicas
Además de la clasificación de Carpentier, se han desarrollado sistemas ecocardiográficos que gradúan la anomalía de Ebstein como leve, moderada o severa, integrando el grado de desplazamiento apical de la valva septal, la proporción de ventrículo derecho atrializado y la dilatación del ventrículo derecho funcional, lo que facilita una valoración rápida y reproducible de la gravedad en la práctica clínica. Algunos autores incorporan índices cuantitativos, como el “Z score” del anillo tricuspídeo, la relación entre el área combinada de aurícula derecha–ventrículo atrializado y el área de las cavidades izquierdas (índice de Celermajer) o la proporción entre volúmenes atrializados y funcionales del ventrículo derecho, para correlacionar de forma más objetiva la anatomía con la repercusión hemodinámica y orientar la indicación de cirugía, derivaciones cavopulmonares complementarias o cierre percutáneo del cortocircuito interauricular.
Desde la perspectiva quirúrgica, se han propuesto subclasificaciones que describen con detalle la morfología de la valva anterior (longitud, extensión hacia el tracto de salida, número de fenestraciones, grado de tethering y delaminación) y el grado de hipoplasia o estenosis del tracto de salida del ventrículo derecho, parámetros decisivos para escoger entre reparación biventricular con plastia tipo cone, reparación de ventrículo y medio o estrategias de ventrículo único. Otros esquemas ecocardiográficos incluyen la evaluación de la función sistólica del ventrículo derecho mediante parámetros de deformación (strain) y desplazamiento del anillo tricuspídeo, así como el estudio de la interacción ventrículo derecho–ventrículo izquierdo, que puede verse comprometida por la dilatación extrema de la cavidad derecha.
En conjunto, estas clasificaciones complementarias no sustituyen a la de Carpentier, pero refinan la caracterización individual del paciente y permiten un enfoque terapéutico más personalizado, ajustado tanto a la anatomía real como a la reserva funcional del ventrículo derecho y a la presencia de disfunción ventricular izquierda asociada. Su utilización sistemática mejora la capacidad de predecir la evolución clínica, seleccionar el momento óptimo de la intervención y comparar resultados entre centros, reforzando el papel de la ecocardiografía como herramienta central en la estratificación de riesgo y en la planificación de la corrección de la anomalía de Ebstein.
Incidencia y epidemiología
La anomalía de Ebstein representa menos del 1 % de todas las cardiopatías congénitas y su incidencia se estima en aproximadamente 1 por cada 200 000 nacidos vivos, lo que la sitúa entre las malformaciones cardiacas menos frecuentes. Estudios poblacionales han mostrado una distribución relativamente uniforme entre sexos, aunque algunos reportes describen una ligera predominancia masculina, sin clara predisposición racial. Un pequeño número de casos se ha relacionado con exposición fetal a litio y otros fármacos durante el primer trimestre del embarazo, aunque la mayoría de los casos son esporádicos y sin un patrón hereditario definido. La mejora de las técnicas de diagnóstico prenatal mediante ecocardiografía fetal ha incrementado la detección in utero, lo que permite una mejor planificación perinatal, pero también pone de manifiesto una elevada mortalidad fetal y neonatal en las formas más severas, en especial cuando se asocian regurgitación tricuspídea masiva y disfunción del ventrículo derecho.
Embriogénesis de la anomalía de Ebstein
La embriogénesis de la anomalía de Ebstein se entiende mejor al contrastarla con el desarrollo normal de la válvula tricúspide. En condiciones normales, las almohadillas endocárdicas del canal auriculoventricular dan origen a las valvas mediante un proceso coordinado de crecimiento, remodelado y delaminación del miocardio ventricular subyacente, que permite que el tejido valvular se separe de la pared y quede suspendido por cuerdas tendinosas y músculos papilares en el plano del anillo auriculoventricular. En la anomalía de Ebstein se produce un fallo parcial o casi completo de esta delaminación, especialmente a nivel de las valvas septal e inferior, que permanecen adheridas al endocardio del ventrículo derecho y se insertan de forma desplazada hacia el ápex. La valva anterior suele conservar mejor delaminación, pero crece de manera redundante y muy móvil, lo que contribuye a la morfología “en vela” característica.
Como consecuencia, la línea de inserción funcional de la válvula tricúspide se desplaza apicalmente, la unión auriculoventricular “desciende” y la porción proximal del ventrículo derecho queda atrializada, comportándose hemodinámicamente como parte de la aurícula derecha, con adelgazamiento progresivo de la pared y distorsión de la geometría ventricular. Este defecto de delaminación se interpreta hoy como una alteración de los mecanismos celulares que convierten las almohadillas endocárdicas en valvas delgadas y móviles; estudios experimentales muestran que la delaminación y el modelado valvular dependen de fuerzas mecánicas normales y de la interacción de vías de señalización como TGF‑β, BMP y Notch, que regulan la transición endotelio‑mesénquima y la organización de la matriz extracelular.
En la mayoría de los pacientes la anomalía de Ebstein es esporádica, pero se han descrito mutaciones raras en genes relacionados con el citoesqueleto sarcomérico (MYH7), factores de transcripción cardiaca (NKX2‑5, GATA4) y otros genes implicados en el desarrollo valvular y del ventrículo derecho, lo que sugiere una heterogeneidad genética con penetrancia variable. Además, se ha observado asociación con algunas alteraciones cromosómicas y síndromes como Down, Noonan o CHARGE, aunque representan una minoría de casos. Se postula que estos defectos genéticos y de señalización alteran la formación de las almohadillas, la reabsorción del miocardio subvalvular y la estratificación de la matriz, dejando valvas engrosadas, mal delimitadas y firmemente ancladas al ventrículo. En suma, la anomalía de Ebstein puede considerarse la expresión macroscópica de un fallo en los programas embrionarios que gobiernan la delaminación y el posicionamiento de la válvula tricúspide, con grado variable de compromiso según la extensión del defecto y la participación de las tres valvas.
Fisiopatología
La fisiopatología de la anomalía de Ebstein está determinada por la combinación de insuficiencia tricuspídea, reducción del ventrículo derecho funcional, presencia de cortocircuitos interauriculares y alta carga de arritmias. El desplazamiento apical y la mala coaptación de las valvas originan una regurgitación sistólica importante hacia la aurícula derecha, que conduce a dilatación progresiva de esta cavidad, aumento de la presión venosa sistémica, hepatomegalia, edemas periféricos e insuficiencia cardiaca derecha en fases avanzadas. La atrialización del ventrículo derecho convierte parte de esta cavidad en un reservorio pasivo, con pared adelgazada y mala contractilidad, lo que reduce el volumen eyectivo efectivo hacia la circulación pulmonar y favorece el bajo gasto pulmonar y la hipoxemia, especialmente cuando coexiste comunicación interauricular con cortocircuito derecha–izquierda. La aurícula derecha enormemente dilatada y la presencia frecuente de vías accesorias alrededor del anillo tricuspídeo predisponen a taquicardias supraventriculares, síndrome de Wolff–Parkinson–White, flutter o fibrilación auricular, arritmias que empeoran la hemodinamia y pueden desencadenar síncope o muerte súbita. En el periodo neonatal, la resistencia vascular pulmonar elevada potencia el cortocircuito derecha–izquierda a través del foramen oval o un defecto septal auricular, produciendo cianosis intensa; al descender fisiológicamente dicha resistencia, algunos lactantes muestran mejoría espontánea, mientras que otros persisten con compromiso hemodinámico severo que obliga a intervenciones farmacológicas o quirúrgicas tempranas.
Detalles hemodinámicos y repercusión sistémica
El atrio derecho y el ventrículo atrializado actúan como una gran cámara de capacitancia sometida a volúmenes regurgitantes crónicos, lo que incrementa el tamaño de la comunicación interauricular y facilita el paso de sangre desaturada hacia la aurícula izquierda, con grados variables de cianosis y policitemia secundaria. Durante la sístole auricular, la porción atrializada puede abombarse hacia afuera como un reservorio ineficaz, reduciendo aún más el volumen que entra al ventrículo derecho funcional y perpetuando el bajo gasto pulmonar. En situaciones de insuficiencia tricuspídea masiva, la presión auricular derecha se eleva de forma sostenida y se transmite al sistema venoso sistémico, generando distensión yugular, congestión hepática crónica, ascitis y, a largo plazo, disfunción hepática y riesgo de cirrosis cardiogénica. El remodelado progresivo del ventrículo derecho y del anillo tricuspídeo empeora el grado de regurgitación, cerrando un círculo vicioso de dilatación–insuficiencia valvular–dilatación; además, la distorsión del septo interventricular y la interdependencia ventricular pueden afectar la función del ventrículo izquierdo, reduciendo el gasto sistémico y agravando la intolerancia al ejercicio. En los casos extremos neonatales, el ventrículo derecho es incapaz de abrir la válvula pulmonar (“atresia pulmonar funcional”), por lo que el flujo pulmonar depende casi por completo del conducto arterioso; el cierre de este sin apoyo farmacológico conduce a colapso circulatorio, lo que explica la necesidad de mantener la permeabilidad ductal con prostaglandinas en las presentaciones críticas.
Tratamiento médico
El tratamiento médico de la anomalía de Ebstein se orienta a controlar la insuficiencia cardiaca, tratar las arritmias y optimizar la oxigenación, ajustándose a la edad y al grado de severidad anatómica. En recién nacidos con cianosis grave y bajo gasto, se pueden utilizar prostaglandinas para mantener el conducto arterioso permeable, soporte inotrópico, ventilación mecánica y manejo cuidadoso de la resistencia vascular pulmonar; en casos menos severos, la observación estrecha puede ser suficiente mientras se espera el descenso fisiológico de la resistencia pulmonar. En niños y adultos, los diuréticos, inhibidores de la enzima convertidora de angiotensina o antagonistas de los receptores de angiotensina, y, en ocasiones, betabloqueantes o digoxina ayudan a controlar síntomas de insuficiencia cardiaca derecha y mejorar la tolerancia al ejercicio. El manejo de las arritmias incluye antiarrítmicos, cardioversión eléctrica en casos agudos y, en muchos pacientes, ablación por catéter de vías accesorias, sola o combinada con cirugía valvular. Es fundamental el seguimiento periódico en unidades de cardiopatías congénitas del adulto o pediátricas especializadas, así como la profilaxis de endocarditis según las recomendaciones vigentes y el asesoramiento sobre actividad física, embarazo y riesgos tromboembólicos.
Tratamiento quirúrgico y estrategias según la clasificación
El tratamiento quirúrgico de la anomalía de Ebstein se reserva para pacientes con insuficiencia tricuspídea severa y síntomas de insuficiencia cardiaca, deterioro progresivo de la función del ventrículo derecho, cianosis significativa, arritmias refractarias o aumento sostenido del tamaño de la aurícula derecha y del ventrículo atrializado, valorados siempre en el contexto de la clasificación anatómica y de la edad del paciente. En las formas menos severas (Carpentier tipo A y buena parte de los tipo B), el objetivo es lograr una reparación biventricular completa, preservando la válvula nativa mediante técnicas de plastia tricuspídea; la estrategia de elección es la reparación tipo cone de da Silva, que recrea un aparato valvular prácticamente anatómico tras completar la delaminación quirúrgica de las valvas, rotar la valva anterior y suturar el tejido valvular como un cono continuo al anillo verdadero, asociando plicatura del ventrículo atrializado y reducción del anillo para restaurar la geometría del ventrículo derecho.
En pacientes con anatomía más compleja (tipo C y algunos tipo D) y ventrículo derecho funcional pequeño o disfuncionante, una reparación biventricular aislada puede resultar inestable; en este grupo se recurre con frecuencia a la estrategia de ventrículo y medio, que combina una plastia tricuspídea (habitualmente tipo cone) con una anastomosis cavopulmonar superior bidireccional (Glenn) para derivar el drenaje de la vena cava superior directamente a las arterias pulmonares. Esta derivación descarga de volumen al ventrículo derecho, mejora la eficiencia de la reparación y reduce la presión auricular derecha, con impacto favorable sobre la aparición de arritmias y la tolerancia al ejercicio. Cuando el ventrículo derecho funcional es mínimo o la morfología valvular es prácticamente irreparable —escenario típico en muchos tipo D y en neonatos con atresia pulmonar funcional— se plantea una circulación de ventrículo único siguiendo la vía Fontan (procedimiento de Starnes modificado u otras variantes), que excluye funcionalmente el ventrículo derecho y canaliza todo el retorno venoso sistémico hacia la circulación pulmonar mediante derivaciones cavopulmonares y, en etapas posteriores, un Fontan total.
El manejo del recién nacido críticamente enfermo exige una estrategia escalonada: inicialmente se optimiza el soporte médico (prostaglandinas, ventilación, manejo de la resistencia vascular pulmonar) y, si la estabilidad no se logra, se valoran procedimientos paliativos como derivaciones sistémico–pulmonares, cerclaje de la arteria pulmonar o exclusión del ventrículo derecho con cierre fenestrado de la tricúspide (procedimiento de Starnes), que actúan como puente a una reparación definitiva o a una circulación univentricular más estable. En centros con alta experiencia, se ha demostrado que incluso en neonatos seleccionados puede realizarse una reparación biventricular precoz con resultados aceptables, siempre que el ventrículo derecho tenga tamaño y presión suficientes para sostener el flujo pulmonar.
La sustitución de la válvula tricúspide mediante prótesis biológicas o mecánicas se reserva para situaciones en las que la reparabilidad es muy limitada o ha fracasado una plastia previa; en estos casos se prefiere la prótesis biológica, menos trombogénica en un ventrículo derecho dilatado y disfuncionante, aunque con riesgo de degeneración estructural a largo plazo. La tendencia actual es preservar siempre que sea posible la válvula nativa, porque la reparación cone y sus variantes han mostrado mejor supervivencia, menor incidencia de trombosis, mejor remodelado del ventrículo derecho y menor necesidad de reintervención que la sustitución primaria.
Las series contemporáneas demuestran una mejora notable en la supervivencia, la capacidad funcional y la calidad de vida tras reparaciones anatómicas bien planificadas, con tasas de insuficiencia tricuspídea residual moderada o severa claramente inferiores a las de las técnicas históricas. Sin embargo, dado que la anomalía de Ebstein es una malformación del ventrículo derecho y de la válvula a lo largo de toda la vida, es imprescindible un seguimiento estrecho en unidades de cardiopatías congénitas del adulto: persiste riesgo de arritmias residuales que pueden requerir ablación, de deterioro progresivo del ventrículo derecho o del circuito Fontan, y de reintervenciones para re-reparación o cambio protésico, por lo que la decisión quirúrgica debe entenderse siempre dentro de una estrategia longitudinal de cuidado del paciente.
Bibliografía
1. Singh DP, et al. Ebstein Anomaly and Malformation.
StatPearls. https://www.ncbi.nlm.nih.gov/books/NBK534824/
2. MSD Manual Professional. Ebstein Anomaly.
https://www.msdmanuals.com/professional/pediatrics/congenital-cardiovascular-anomalies/ebstein-anomaly
3. NeoCardio Lab. Ebstein’s anomaly.
https://www.neocardiolab.com/congenital-heart-defects/ebsteins-anomaly
4. NeoCardio Lab. Fetal Ebstein Anomaly.
https://www.neocardiolab.com/fetal-echocardiography/fetal-ebstein-anomaly
5. Attenhofer Jost CH, et al. Ebstein’s Anomaly. Circulation.
https://www.ahajournals.org/doi/10.1161/circulationaha.106.619338
6. Sainathan S, et al. Ebstein’s anomaly: contemporary management strategies.
https://jtd.amegroups.org/article/view/37143/html
7. Strategy and technique for surgical treatment of Ebstein’s anomaly.
https://pmc.ncbi.nlm.nih.gov/articles/PMC11101237/
8. CHOP. Ebstein’s Anomaly of the Tricuspid Valve.
https://www.chop.edu/conditions-diseases/ebstein-s-anomaly-tricuspid-valve
9. Orphanet. Ebstein malformation of the tricuspid valve.
https://www.orpha.net/en/disease/detail/1880
10. Texas Children’s Hospital. Ebstein Anomaly.
https://www.texaschildrens.org/sites/default/files/uploads/documents/heart/Ebstein%20Anomaly.pdf
